با اشتراک در خبرنامه همیشه از آخرین تخفیفات و رویدادهای مهم ما مطلع خواهید شد
خواص شیمیایی و کاربردهای پرمنگنات پتاسیم
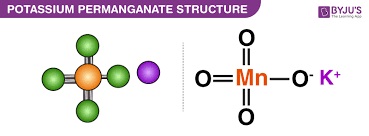
پرمنگنات پتاسیم دارای فرمول شیمیایی KMnO4 است. حل شدن در آب یکی از خواص شیمیایی پرمنگنات پتاسیم است. اولین کشف تولید KMnO4 در سال 1659 توسط یوهان گلابر، شیمیدان آلمانی هلندی انجام شد. پرمنگنات پتاسیم، از دو یون تشکیل شده است: یون پرمنگنات (MnO4–) و یون پتاسیم (K+) که توسط یک پیوند یونی در کنار هم قرار می گیرند. در حالت فیزیکی به صورت جامد تیره ارغوانی رنگ و بدون بو ظاهر می شود. KMnO4 در دسته ترکیبات معدنی قرار می گیرد. این ترکیب به دلیل خواص اکسید کننده استثنایی خود شناخته شده است.
تهیه پرمنگنات پتاسیم
کانسنگ پیرولوزیت با KOH (یا K2CO3) در حضور هوا یا عوامل اکسید کننده مانند KNO3 یا KClO3 ترکیب می شود تا منگنات پتاسیم K2MnO4 را که توده سبز نامیده می شود، تشکیل دهد.
2MnO2 + O2 + 4KOH → 2K2MnO4 + 2H2O
منگنات پتاسیم برای تشکیل پرمنگنات پتاسیم با استفاده از HCl یا H2SO4 مصرف می شود.
معادله تهیه KMnO4 با استفاده از HCl به شکل زیر است.
2K2MnO4 + 4HCl → 2KMnO4 + H2O + MnO2 + 4KCl
معادله مورد استفاده در تهیه KMnO4 با استفاده از H2SO4 در زیر آمده است:
3K2MnO4 + 2H2SO4 → 2KMnO4 + 2H2O + MnO2 + 2K2SO4
تهیه آزمایشگاهی پرمنگنات پتاسیم شامل واکنش یک اکسید کننده (یون دوظرفیتی منگنز (II)) با پراکسید سولفات به صورت زیر است.
2Mn+2 + 5S2O8-2 + 8H2O → 2MnO4– + 10 SO4-2+ 16H+
خواص شیمیایی پرمنگنات پتاسیم
با افزایش حرارت، پرمنگنات پتاسیم تجزیه شده و به منگنات پتاسیم و دی اکسید منگنز تبدیل می شود.
2KMnO4 → 2K2MnO4 + MnO2 + O2
در واکنش با H2SO4 سرد و غلیظ، پرمنگنات پتاسیم به هپتوکسید منگنز تجزیه میشود که با آزاد کردن انرژی زیادی همراه است.
2KMnO4 + 2H2SO4 (سرد) → Mn2O7 + 2KHSO4 + H2O (سرد)
Mn2O7 →Δ→ 2MnO2 + 3O2
در واکنش با H2SO4 غلیظ داغ، MnSO4 تولید می کند
4KMnO4 + 6H2SO4 (گرم) → 4MnSO4 + 2K2SO4 + 6H2O + 5O2 (گرم)
پرمنگنات پتاسیم یک عامل اکسید کننده بوده که در واکنش های مختلف اکسیداسیون دخیل است. واکنش های اکسیداسیون در محیط های مختلف به صورت زیر است.
اکسیداسیون در یک محیط خنثی، پرمنگنات پتاسیم به MnO2 کاهش می یابد.
MnO4- + 2H2O + 3e- → MnO2 + 4OH-
اکسید کردن H2S به گوگرد
3H2S + 2MnO4- → 2MnO2 + 2OH- + 3S + + 2H2O
اکسید شدن تیوسولفات به سولفات
8MnO4- + 3S2O32- + H2O → 6SO42- + 8MnO2 + 2OH-
اکسیداسیون در محیط قلیایی
MnO4- + 2H2O + 3e- → MnO2 + 4OH-

کاربردهای پرمنگنات پتاسیم
از ترکیب پرمنگنات پتاسیم برای تعیین ارزش پرمنگنات در تجزیه و تحلیل کیفی استفاده می شود.
در طول تصفیه آب چاه، از ماده شیمیایی KMnO4 استفاده می شود زیرا به حذف سولفید هیدروژن و آهن کمک می کند.
پرمنگنات پتاسیم همچنین به درمان بیماری های پوستی مختلف از جمله درماتیت، عفونت قارچی پا و غیره کمک می کند، بنابراین به عنوان یک ضد عفونی کننده عمل می کند.
پرمنگنات پتاسیم همچنین به درمان عفونت های باکتریایی کمک می کند.
در دباغی چرم و چاپ پارچه مفید است.
به عنوان یک عامل سفید کننده، ضد عفونی کننده و آفت کش استفاده می شود.
به عنوان یک عامل اکسید کننده عمل می کند و به سنتز ترکیبات مهم مختلف کمک می کند.
پرمنگنات پتاسیم همچنین به عنوان پادزهر برای کلرال هیدرات یا مسمومیت با آلکالوئید عمل می کند و عمدتاً در باربیتورات ها دیده می شود.
محلول پرمنگنات پتاسیم با غلظت 1:5000 به عنوان شستشوی معده مورد استفاده قرار می گیرد و همچنین به اکسید شدن سم و جلوگیری از جذب آن کمک می کند.
برای تهیه پرمنگنات پتاسیم به راحتی می توانید از سایت فلات کالا خرید کنید.

تهیه پرمنگنات پتاسیم
کانسنگ پیرولوزیت با KOH (یا K2CO3) در حضور هوا یا عوامل اکسید کننده مانند KNO3 یا KClO3 ترکیب می شود تا منگنات پتاسیم K2MnO4 را که توده سبز نامیده می شود، تشکیل دهد.
2MnO2 + O2 + 4KOH → 2K2MnO4 + 2H2O
منگنات پتاسیم برای تشکیل پرمنگنات پتاسیم با استفاده از HCl یا H2SO4 مصرف می شود.
معادله تهیه KMnO4 با استفاده از HCl به شکل زیر است.
2K2MnO4 + 4HCl → 2KMnO4 + H2O + MnO2 + 4KCl
معادله مورد استفاده در تهیه KMnO4 با استفاده از H2SO4 در زیر آمده است:
3K2MnO4 + 2H2SO4 → 2KMnO4 + 2H2O + MnO2 + 2K2SO4
تهیه آزمایشگاهی پرمنگنات پتاسیم شامل واکنش یک اکسید کننده (یون دوظرفیتی منگنز (II)) با پراکسید سولفات به صورت زیر است.
2Mn+2 + 5S2O8-2 + 8H2O → 2MnO4– + 10 SO4-2+ 16H+
خواص شیمیایی پرمنگنات پتاسیم
با افزایش حرارت، پرمنگنات پتاسیم تجزیه شده و به منگنات پتاسیم و دی اکسید منگنز تبدیل می شود.
2KMnO4 → 2K2MnO4 + MnO2 + O2
در واکنش با H2SO4 سرد و غلیظ، پرمنگنات پتاسیم به هپتوکسید منگنز تجزیه میشود که با آزاد کردن انرژی زیادی همراه است.
2KMnO4 + 2H2SO4 (سرد) → Mn2O7 + 2KHSO4 + H2O (سرد)
Mn2O7 →Δ→ 2MnO2 + 3O2
در واکنش با H2SO4 غلیظ داغ، MnSO4 تولید می کند
4KMnO4 + 6H2SO4 (گرم) → 4MnSO4 + 2K2SO4 + 6H2O + 5O2 (گرم)
پرمنگنات پتاسیم یک عامل اکسید کننده بوده که در واکنش های مختلف اکسیداسیون دخیل است. واکنش های اکسیداسیون در محیط های مختلف به صورت زیر است.
اکسیداسیون در یک محیط خنثی، پرمنگنات پتاسیم به MnO2 کاهش می یابد.
MnO4- + 2H2O + 3e- → MnO2 + 4OH-
اکسید کردن H2S به گوگرد
3H2S + 2MnO4- → 2MnO2 + 2OH- + 3S + + 2H2O
اکسید شدن تیوسولفات به سولفات
8MnO4- + 3S2O32- + H2O → 6SO42- + 8MnO2 + 2OH-
اکسیداسیون در محیط قلیایی
MnO4- + 2H2O + 3e- → MnO2 + 4OH-

کاربردهای پرمنگنات پتاسیم
از ترکیب پرمنگنات پتاسیم برای تعیین ارزش پرمنگنات در تجزیه و تحلیل کیفی استفاده می شود.
در طول تصفیه آب چاه، از ماده شیمیایی KMnO4 استفاده می شود زیرا به حذف سولفید هیدروژن و آهن کمک می کند.
پرمنگنات پتاسیم همچنین به درمان بیماری های پوستی مختلف از جمله درماتیت، عفونت قارچی پا و غیره کمک می کند، بنابراین به عنوان یک ضد عفونی کننده عمل می کند.
پرمنگنات پتاسیم همچنین به درمان عفونت های باکتریایی کمک می کند.
در دباغی چرم و چاپ پارچه مفید است.
به عنوان یک عامل سفید کننده، ضد عفونی کننده و آفت کش استفاده می شود.
به عنوان یک عامل اکسید کننده عمل می کند و به سنتز ترکیبات مهم مختلف کمک می کند.
پرمنگنات پتاسیم همچنین به عنوان پادزهر برای کلرال هیدرات یا مسمومیت با آلکالوئید عمل می کند و عمدتاً در باربیتورات ها دیده می شود.
محلول پرمنگنات پتاسیم با غلظت 1:5000 به عنوان شستشوی معده مورد استفاده قرار می گیرد و همچنین به اکسید شدن سم و جلوگیری از جذب آن کمک می کند.
برای تهیه پرمنگنات پتاسیم به راحتی می توانید از سایت فلات کالا خرید کنید.


