با اشتراک در خبرنامه همیشه از آخرین تخفیفات و رویدادهای مهم ما مطلع خواهید شد
سنتز پتاسیم کلرات KClO3 با الکترولیز
از روش سنتز کلرات پتاسیم در صنعت برای تولید انبوه ترکیب مذکور استفاده می شود. این فرآیند بر اساس الکترولیز محلول آبی کلرید سدیم است. محصول این واکنش کلرات سدیم است. پس از آن، از طریق فرآیند تبادل یونی بین کلرید پتاسیم و کلرات سدیم، می توان کلرات پتاسیم و کلرید سدیم را بدست آورد. از این مرحله در روش تجزیه حرارتی نیز استفاده می شود. به عنوان یک الکترولیت، می توان از محلول های سایر کلریدهای فلزی (به عنوان مثال، باریم یا کلرید پتاسیم) نیز استفاده کرد. با این حال، استفاده از کلرید سدیم مزایای خود را دارد - به عنوان مثال، محصول (کلرات سدیم) بسیار بیشتر از باریم یا کلرات پتاسیم در آب حل می شود. به همین دلیل، پس از پایان واکنش الکترولیز، محصول کاملاً حل می شود و این امر فیلتراسیون الکترولیت را آسان می کند، زیرا با فیلتراسیون می توان تمام ناخالصی ها را بدون حذف مقداری از محصول مورد نظر حذف کرد. همانطور که قبلاً ذکر کردم، بعداً می توان از کلرات سدیم به دست آمده برای ساخت کلرات پتاسیم (یا کلرات باریم که در صنعت آتش بازی نیز مهم است) از طریق یک واکنش تبادل یونی ساده استفاده کرد. اگرچه از این روش در تولید انبوه ترکیبات ذکر شده استفاده می شود، اما می توان از آن برای ساخت مقادیر کمتری از این محصولات نیز استفاده کرد.
در مورد تئوری این روش، فرآیند هنوز به طور کامل توضیح داده نشده است، اما نظریه ای که بیش از 80 سال پیش توسط فریتز فورستر و اریش مولر مطرح شد، توسط جامعه علمی پذیرفته شد. بر اساس آن نظریه، روی آند واکنش زیر رخ می دهد:
در حالی که در کاتد، هیدروژن آب کاهش می یابد:
کلری که بر روی آند تولید می شود در آب حل می شود و در نتیجه اسید هیپوکلرو و همچنین یون های هیدروژن و کلرید تشکیل می شود:
در شرایطی که کلر محلول کمتری نسبت به آنچه باید باشد، محتوای یون های هیدروژن کاهش می یابد و در نتیجه، تمام یون های هیدروکسیدی که روی کاتد تشکیل می شوند، نمی توانند خنثی شوند. این امر می تواند منجر به افزایش PH محلول واکنش شود (به این دلیل هر چند وقت یک بار باید PH محلول را چک کرد و در صورت افزایش pH باید مقدار معینی اسید کلریدریک اضافه کرد. برای کاهش pH). از آخرین معادله ذکر شده می توان دریافت که اسید هیپوکلرو نیز در حال تولید است که در واکنش با آب یون های هیپوکلریت (ClO-) و هیدروژن (H3O+) می دهد. غلظت دقیق یون های کلر محلول، اسید هیپوکلرو و هیپوکلریت به شرایط زیر بستگی دارد: pH محلول، دما، فشار و غیره. در مورد تشکیل کلرات، واکنش ها را می توان با این دو معادله نشان داد:
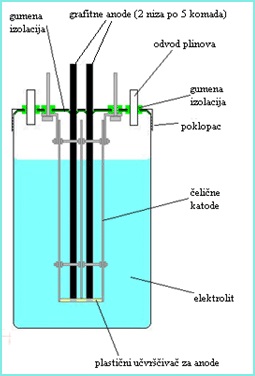
اولین و شاید مهم ترین گام، ساخت سلول های الکترولیتی است. تصاویر بالا و پایین نمای کلی روشنی از ساختار سلول را ارائه می دهند.

اساس ساختار ظروف شیشه ای ساده است. روی هر یک از درب های این کوزه ها 14 سوراخ در اندازه های مختلف ایجاد شده است. دو مورد از آنها برای تبادل گاز، دو مورد برای پیچ و مهره های متصل به کاتد و 10 سوراخ باقی مانده برای آندهای گرافیت در نظر گرفته شده است. کلیه قطعات مذکور که از درب آن عبور می کردند با لاستیک عایق بندی می شوند تا در تماس مستقیم با درب قرار نگیرند (برای جلوگیری از اتصال کوتاه احتمالی). علاوه بر این، به سمت پایین درب ها، یک لایه لاستیکی اضافی با سوراخ های باریک در محل هایی که قطعات از درب عبور می کردند، وصل شده است. به این ترتیب، تمام گازهای تولید شده توسط سلول های الکترولیتی، از طریق لوله های شیشه ای کوچکی که برای این منظور طراحی شده بودند، از سلول ها خارج می شوند. در مورد کاتدها، آنها در هر سلول با استفاده از دو پیچ به هم متصل شدند. این پیچها همچنیناین ام کان را میدهد که فاصله بین صفحات کاتد و آندهای گرافیت را به دلخواه تنظیم و افزایش دهیم تا از تماس بین کاتدها و آندها که باعث اتصال کوتاه میشود، جلوگیری شود. برای ایمنی بیشتر، همچنین یک تقویت کننده پلاستیکی در پایین سلول ها قرار داده می شودکه از تماس نهایی بین آندها و کاتدها نیز جلوگیری گردد.
انتخاب موادی که قسمت های خاصی از سلول ها از آنها ساخته شده اند نیز بسیار مهم است. بنابراین، شاید مهمترین بخش آندها باشد. آنها باید در برابر کلری که روی سطح آندها تولید می شود، مقاوم باشند. ماده تقریبا ایده آل برای آندها پلاتین است که با سرعت بسیار کم خورده می شود (در مقایسه با گرافیت). به لطف خوردگی ناچیز پلاتین، در پایان واکنش، محلولی با ناخالصی های بسیار کم به دست می آید و به همین دلیل، پالایش بیشتر الکترولیت تا حد زیادی ساده می شود. تنها عیب پلاتین قیمت بسیار بالای آن است که تنها دلیل استفاده نکردن من از این ماده است. جایگزین های مختلفی برای این ماده وجود دارد. شناخته شده ترین آنها اکسید سرب (IV) و گرافیت هستند. اولین مورد ذکر شده در باتری های سرب نیز استفاده می شود و در این مورد به دلیل مقاوم بودن نسبی در برابر خوردگی حتی زمانی که الترولیز در دماهای بالاتر انجام می شود (که باعث افزایش بازده الکترولیز می شود) مفید است.گرافیت ارزان است و به راحتی پیدا می شود. متأسفانه، چند اشکال دارد - به طور کامل در برابر شرایط موجود در سلول ها در طول الکترولیز مقاوم نیست، بنابراین با سرعت نسبتا بالایی خورده می شود. این یک مشکل اضافی ایجاد می کند، الکترولیت را آلوده می کند و می تواند بعداً عوارض بیشتری ایجاد کند، بنابراین لازم است الکترولیت پس از تکمیل فرآیند فیلتر شود. با وجود ایرادات ذکر شده، با نزدیک نگه داشتن شرایط به حالت ایده آل، می توان خوردگی آندهای گرافیت را به حداقل ممکن کاهش داد.
به همین دلیل، هنوز هم می توان از گرافیت با نتایج نسبتاً خوبی استفاده کرد. علاوه بر این، یکی دیگر از مزایای این ماده قیمت پایین آن است. معمولا از الکترودهای گرافیتی استفاده می شود که معمولاً برای جوشکاری استفاده می شوند و در مغازه هایی که تجهیزات جوشکاری می فروشند یافت می شوند. این الکترودها با یک لایه نازک مس پوشانده شده اند، که جدا کردن این مس نسبتاً ساده است. پس از آن، آندها کمی کوتاه شده و در سوراخ هایی که از درب سلول ها ایجاد شده بود قرار می گیرند. در مورد کاتدها، می توان از طیف وسیعی از مواد استفاده کرد، زیرا تا حدی در برابر خوردگی ناشی از آندها محافظت می شوند و این امکان انتخاب بسیار گسترده تری از مواد را فراهم می کند. یک ماده خوب فولاد ضد زنگ است که ارزان است و به راحتی پیدا می شود. فیکسچر آند از پلیپروپیلن (PP) و لولههای خروج گاز از شیشه ساخته می شوند و بیشتر موارد پیچ ها نیز از فولاد ضد زنگ ساخته می شوند. مواد عایق لاستیکی نیز در برابر خوردگی مقاوم هستند.
در مورد الکترولیت، معمولا از محلول آبی اشباع کلرید سدیم استفاده می شود که با حل کردن 350 گرم نمک طعام در یک لیتر آب مقطر تهیه می گردد. برای تسریع در انحلال، محلول به آرامی حرارت داده می شود. برای کاهش خوردگی کاتدها، ایده خوبی است که مقداری دی کرومات پتاسیم به الکترولیت (حدود 6 گرم در هر لیتر الکترولیت) اضافه کنید. با افزودن ترکیب مذکور، در طی فرآیند الکترولیز، در اطراف کاتدها اکسیدهای کروم هیدراته تشکیل می شود. این اکسیدها علاوه بر این از کاتدها در برابر کلرات محافظت می کند. توجه داشته باشید که دی کرومات پتاسیم به عنوان یک ماده سرطان زا شناخته شده است.
در مورد منبع تغذیه، می توانید از یک منبع تغذیه از یک رایانه قدیمی استفاده کنید که به منظور ایجاد جریان متناوب با مقدار مورد نظر جریان الکتریکی اصلاح می شود. برای تشکیل یک مول یون کلرات، شش مول الکترون نیاز است بنابراین برای سنتز یک مول کلرات سدیم، 160.8 Ah الکتریسیته مورد نیاز است. از آنجایی که سلول ها در یک مدار سری قرار دارند و با استفاده از جریان الکتریکی 3 آمپر، زمان لازم برای تبدیل یک مول NaCl به یک مول NaClO3 برابر با 26.8 ساعت است. مثلا اگر در هر سلول الکترولیتی 500 میلی لیتر از محلول NaCl اشباع وجود داشته باشد، در مجموع، در حدود 350 گرم NaCl، یعنی حدود 5.9 مول مورد نیاز است. در نهایت، نتیجه این است که واکنش باید به مدت 158.12 ساعت در حال انجام باشد تا تمام NaCl به NaClO3 تبدیل شود. در مورد ولتاژ، حدود 3 ولت برای اکسیداسیون کلرید به یون کلرات (و برای کاهش هیدروژن روی کاتد) مورد نیاز است. در صورت وجود مقاومت الکتریکی می توان ولتاژ را اضافه کرد.
در طول الکترولیز، باید مراقب شرایط خاصی نیز باشد - دما، pH و غلظت کلرید سدیم. مقادیر دما هرگز از حد ایمنی (حدود 40 درجه سانتیگراد) نبایستی بیشتر شود.
pH و غلظت NaCl نیاز به توجه بیشتری دارد. pH به تدریج در طول الکترولیز افزایش می یابد و مقدار ایده آل آن نزدیک به 6 است. غلظت NaCl به تدریج کاهش می یابد، اما غلظت بهینه حدود 300 گرم در لیتر است، زیرا با کاهش غلظت NaCl، خوردگی آندها افزایش می یابد. ، که باید از آن اجتناب کرد. این مشکلات با افزودن مقدار معینی محلول اسیدی اشباع NaCl هر 24 ساعت حل می شود.
مقدار NaCl مورد نیاز را می توان به راحتی با در نظر گرفتن زمان سپری شده از آخرین افزودن محلول محاسبه کرد، زیرا مشخص است که چه مقدار از NaCl در هر ساعت به NaClO3 وارد می شود. علاوه بر این، محلول با مقدار معینی اسید هیدروکلریک اسیدی می گردد. به این ترتیب، با هر افزودن NaCl، مقدار pH به سطح بهینه نزدیکتر میشود. با افزودن محلول مذکور گاهی اوقات تولید کلر افزایش می یابد. این نشان می دهد که محلول به اندازه کافی اسیدی است زیرا در این شرایط تولید کلر قابل انتظار است. این مشکل با هدایت گازهایی که در واکنش تولید می شوند به یک لیوان جداگانه حاوی محلول بی کربنات سدیم حل می شود.
پس از گذشت 160 ساعت از شروع الکترولیز، فرآیند به پایان می رسد. الکترولیت چند بار با کمک یک گاز دارویی فیلتر می شود تا ذرات ناخواسته بزرگتر را فیلتر کند. پس از آن، الکترولیت بیشتر از طریق پشم پنبه ای که در یک گلوگاه (یک بطری دو لیتری بزرگتر) قرار داده شده بود، فیلتر می گردد. به تدریج، با فیلتراسیون مکرر، محلول شفاف زرد رنگ به دست آمد. در محلول فیلتر شده، همراه با کلرات سدیم، مقداری هیپوکلریت سدیم نیز وجود دارد. به همین دلیل محلول را تا رسیدن به نقطه جوش حرارت می دهند و حدود 15 دقیقه در آن دما نگه می دارند. در این مرحله، بیشتر هیپوکلریت سدیم به کلرات سدیم تبدیل می شود (که اساس روش هیپوکلریتی سنتز کلرات نیز می باشد). بعد از 15 دقیقه حرارت دادن، pH محلول را بررسی کرده و مقداری محلول هیدروکسید سدیم اضافه کنید تا PH به 8 نزدیک شود. با 350 گرم کلرید سدیم، می توان حدود 627 گرم کلرات سدیم به دست آورد که فقط در تئوری امکان پذیر است (بازده این نوع سلول های خانگی عمدتاً حدود 50٪ است).
مثلا اگر از 60 میلی لیتر محلول فیلتر شده استفاده کنید، از نظر تئوری می تواند محتوی 37.2 گرم کلرات سدیم باشد. با در نظر گرفتن این مقدار، مقدار کلرید پتاسیم مورد نیاز برای واکنش تبادل یونی برابر با 26.1 گرم است. بعد از اضافه کردن کلرید پتاسیم مقدار کمی کاملا حل نمی شود، بنابراین مقداری آب اضافه می کنند تا کاملا حل شود. پس از آن محلول تا دمای اتاق خنک می شود و سپس تا دمای 0 درجه سانتی گراد ادامه می یابد. بلورهای کلرات پتاسیم در کف بشر با محلول سرد شده تشکیل میشوند. پس از فیلتراسیون و خشک شدن، جرم کلرات پتاسیم 10.8 گرم می باشد.
در مورد تئوری این روش، فرآیند هنوز به طور کامل توضیح داده نشده است، اما نظریه ای که بیش از 80 سال پیش توسط فریتز فورستر و اریش مولر مطرح شد، توسط جامعه علمی پذیرفته شد. بر اساس آن نظریه، روی آند واکنش زیر رخ می دهد:
2Cl- -› Cl2 (aq) + 2 electrons
در حالی که در کاتد، هیدروژن آب کاهش می یابد:
-2H2O + 2 electrons -› H2 + 2OH
کلری که بر روی آند تولید می شود در آب حل می شود و در نتیجه اسید هیپوکلرو و همچنین یون های هیدروژن و کلرید تشکیل می شود:
-Cl2 (aq) + H2O -› HClO + H+ + Cl
در شرایطی که کلر محلول کمتری نسبت به آنچه باید باشد، محتوای یون های هیدروژن کاهش می یابد و در نتیجه، تمام یون های هیدروکسیدی که روی کاتد تشکیل می شوند، نمی توانند خنثی شوند. این امر می تواند منجر به افزایش PH محلول واکنش شود (به این دلیل هر چند وقت یک بار باید PH محلول را چک کرد و در صورت افزایش pH باید مقدار معینی اسید کلریدریک اضافه کرد. برای کاهش pH). از آخرین معادله ذکر شده می توان دریافت که اسید هیپوکلرو نیز در حال تولید است که در واکنش با آب یون های هیپوکلریت (ClO-) و هیدروژن (H3O+) می دهد. غلظت دقیق یون های کلر محلول، اسید هیپوکلرو و هیپوکلریت به شرایط زیر بستگی دارد: pH محلول، دما، فشار و غیره. در مورد تشکیل کلرات، واکنش ها را می توان با این دو معادله نشان داد:
-2HClO + ClO- -› ClO3- + H+ + 2Cl
و
2HClO + ClO- + 2OH- -› ClO3- + 2Cl- + H2O
می توان دید که برای تشکیل یون های کلرات، باید غلظت هیپوکلرو اسید و یون های هیپوکلریت را تا حد امکان بالا نگه داشت. این کار با نگه داشتن الکترولیت در سطح کمی اسیدی (pH=6) انجام می شود. در صورت وجود چنین اسیدی، نسبت بین یون های هیپوکلرو اسید و هیپوکلریت بهینه است (2:1، همانطور که در معادلات واکنش بالا مشاهده می شود). در مورد دما، مقادیر بهینه بین 60 تا 80 درجه سانتیگراد است (زمانی که کاتدها و آندها از مواد ایده آل ساخته شده باشند)، اما از آنجایی که در این مورد از آندهای گرافیت استفاده شده است (که ایده آل نیستند، اما به اندازه کافی خوب هستند) ، دمای ترجیحی حدود 40 درجه سانتیگراد است. دماهای بالاتر تجزیه آندها را تسریع می کند، که به هر حال این تجزیه تقریباً اجتناب ناپذیر است.
اولین و شاید مهم ترین گام، ساخت سلول های الکترولیتی است. تصاویر بالا و پایین نمای کلی روشنی از ساختار سلول را ارائه می دهند.

اساس ساختار ظروف شیشه ای ساده است. روی هر یک از درب های این کوزه ها 14 سوراخ در اندازه های مختلف ایجاد شده است. دو مورد از آنها برای تبادل گاز، دو مورد برای پیچ و مهره های متصل به کاتد و 10 سوراخ باقی مانده برای آندهای گرافیت در نظر گرفته شده است. کلیه قطعات مذکور که از درب آن عبور می کردند با لاستیک عایق بندی می شوند تا در تماس مستقیم با درب قرار نگیرند (برای جلوگیری از اتصال کوتاه احتمالی). علاوه بر این، به سمت پایین درب ها، یک لایه لاستیکی اضافی با سوراخ های باریک در محل هایی که قطعات از درب عبور می کردند، وصل شده است. به این ترتیب، تمام گازهای تولید شده توسط سلول های الکترولیتی، از طریق لوله های شیشه ای کوچکی که برای این منظور طراحی شده بودند، از سلول ها خارج می شوند. در مورد کاتدها، آنها در هر سلول با استفاده از دو پیچ به هم متصل شدند. این پیچها همچنیناین ام کان را میدهد که فاصله بین صفحات کاتد و آندهای گرافیت را به دلخواه تنظیم و افزایش دهیم تا از تماس بین کاتدها و آندها که باعث اتصال کوتاه میشود، جلوگیری شود. برای ایمنی بیشتر، همچنین یک تقویت کننده پلاستیکی در پایین سلول ها قرار داده می شودکه از تماس نهایی بین آندها و کاتدها نیز جلوگیری گردد.
انتخاب موادی که قسمت های خاصی از سلول ها از آنها ساخته شده اند نیز بسیار مهم است. بنابراین، شاید مهمترین بخش آندها باشد. آنها باید در برابر کلری که روی سطح آندها تولید می شود، مقاوم باشند. ماده تقریبا ایده آل برای آندها پلاتین است که با سرعت بسیار کم خورده می شود (در مقایسه با گرافیت). به لطف خوردگی ناچیز پلاتین، در پایان واکنش، محلولی با ناخالصی های بسیار کم به دست می آید و به همین دلیل، پالایش بیشتر الکترولیت تا حد زیادی ساده می شود. تنها عیب پلاتین قیمت بسیار بالای آن است که تنها دلیل استفاده نکردن من از این ماده است. جایگزین های مختلفی برای این ماده وجود دارد. شناخته شده ترین آنها اکسید سرب (IV) و گرافیت هستند. اولین مورد ذکر شده در باتری های سرب نیز استفاده می شود و در این مورد به دلیل مقاوم بودن نسبی در برابر خوردگی حتی زمانی که الترولیز در دماهای بالاتر انجام می شود (که باعث افزایش بازده الکترولیز می شود) مفید است.گرافیت ارزان است و به راحتی پیدا می شود. متأسفانه، چند اشکال دارد - به طور کامل در برابر شرایط موجود در سلول ها در طول الکترولیز مقاوم نیست، بنابراین با سرعت نسبتا بالایی خورده می شود. این یک مشکل اضافی ایجاد می کند، الکترولیت را آلوده می کند و می تواند بعداً عوارض بیشتری ایجاد کند، بنابراین لازم است الکترولیت پس از تکمیل فرآیند فیلتر شود. با وجود ایرادات ذکر شده، با نزدیک نگه داشتن شرایط به حالت ایده آل، می توان خوردگی آندهای گرافیت را به حداقل ممکن کاهش داد.
به همین دلیل، هنوز هم می توان از گرافیت با نتایج نسبتاً خوبی استفاده کرد. علاوه بر این، یکی دیگر از مزایای این ماده قیمت پایین آن است. معمولا از الکترودهای گرافیتی استفاده می شود که معمولاً برای جوشکاری استفاده می شوند و در مغازه هایی که تجهیزات جوشکاری می فروشند یافت می شوند. این الکترودها با یک لایه نازک مس پوشانده شده اند، که جدا کردن این مس نسبتاً ساده است. پس از آن، آندها کمی کوتاه شده و در سوراخ هایی که از درب سلول ها ایجاد شده بود قرار می گیرند. در مورد کاتدها، می توان از طیف وسیعی از مواد استفاده کرد، زیرا تا حدی در برابر خوردگی ناشی از آندها محافظت می شوند و این امکان انتخاب بسیار گسترده تری از مواد را فراهم می کند. یک ماده خوب فولاد ضد زنگ است که ارزان است و به راحتی پیدا می شود. فیکسچر آند از پلیپروپیلن (PP) و لولههای خروج گاز از شیشه ساخته می شوند و بیشتر موارد پیچ ها نیز از فولاد ضد زنگ ساخته می شوند. مواد عایق لاستیکی نیز در برابر خوردگی مقاوم هستند.
در مورد الکترولیت، معمولا از محلول آبی اشباع کلرید سدیم استفاده می شود که با حل کردن 350 گرم نمک طعام در یک لیتر آب مقطر تهیه می گردد. برای تسریع در انحلال، محلول به آرامی حرارت داده می شود. برای کاهش خوردگی کاتدها، ایده خوبی است که مقداری دی کرومات پتاسیم به الکترولیت (حدود 6 گرم در هر لیتر الکترولیت) اضافه کنید. با افزودن ترکیب مذکور، در طی فرآیند الکترولیز، در اطراف کاتدها اکسیدهای کروم هیدراته تشکیل می شود. این اکسیدها علاوه بر این از کاتدها در برابر کلرات محافظت می کند. توجه داشته باشید که دی کرومات پتاسیم به عنوان یک ماده سرطان زا شناخته شده است.

در مورد منبع تغذیه، می توانید از یک منبع تغذیه از یک رایانه قدیمی استفاده کنید که به منظور ایجاد جریان متناوب با مقدار مورد نظر جریان الکتریکی اصلاح می شود. برای تشکیل یک مول یون کلرات، شش مول الکترون نیاز است بنابراین برای سنتز یک مول کلرات سدیم، 160.8 Ah الکتریسیته مورد نیاز است. از آنجایی که سلول ها در یک مدار سری قرار دارند و با استفاده از جریان الکتریکی 3 آمپر، زمان لازم برای تبدیل یک مول NaCl به یک مول NaClO3 برابر با 26.8 ساعت است. مثلا اگر در هر سلول الکترولیتی 500 میلی لیتر از محلول NaCl اشباع وجود داشته باشد، در مجموع، در حدود 350 گرم NaCl، یعنی حدود 5.9 مول مورد نیاز است. در نهایت، نتیجه این است که واکنش باید به مدت 158.12 ساعت در حال انجام باشد تا تمام NaCl به NaClO3 تبدیل شود. در مورد ولتاژ، حدود 3 ولت برای اکسیداسیون کلرید به یون کلرات (و برای کاهش هیدروژن روی کاتد) مورد نیاز است. در صورت وجود مقاومت الکتریکی می توان ولتاژ را اضافه کرد.
در طول الکترولیز، باید مراقب شرایط خاصی نیز باشد - دما، pH و غلظت کلرید سدیم. مقادیر دما هرگز از حد ایمنی (حدود 40 درجه سانتیگراد) نبایستی بیشتر شود.
pH و غلظت NaCl نیاز به توجه بیشتری دارد. pH به تدریج در طول الکترولیز افزایش می یابد و مقدار ایده آل آن نزدیک به 6 است. غلظت NaCl به تدریج کاهش می یابد، اما غلظت بهینه حدود 300 گرم در لیتر است، زیرا با کاهش غلظت NaCl، خوردگی آندها افزایش می یابد. ، که باید از آن اجتناب کرد. این مشکلات با افزودن مقدار معینی محلول اسیدی اشباع NaCl هر 24 ساعت حل می شود.

مقدار NaCl مورد نیاز را می توان به راحتی با در نظر گرفتن زمان سپری شده از آخرین افزودن محلول محاسبه کرد، زیرا مشخص است که چه مقدار از NaCl در هر ساعت به NaClO3 وارد می شود. علاوه بر این، محلول با مقدار معینی اسید هیدروکلریک اسیدی می گردد. به این ترتیب، با هر افزودن NaCl، مقدار pH به سطح بهینه نزدیکتر میشود. با افزودن محلول مذکور گاهی اوقات تولید کلر افزایش می یابد. این نشان می دهد که محلول به اندازه کافی اسیدی است زیرا در این شرایط تولید کلر قابل انتظار است. این مشکل با هدایت گازهایی که در واکنش تولید می شوند به یک لیوان جداگانه حاوی محلول بی کربنات سدیم حل می شود.

پس از گذشت 160 ساعت از شروع الکترولیز، فرآیند به پایان می رسد. الکترولیت چند بار با کمک یک گاز دارویی فیلتر می شود تا ذرات ناخواسته بزرگتر را فیلتر کند. پس از آن، الکترولیت بیشتر از طریق پشم پنبه ای که در یک گلوگاه (یک بطری دو لیتری بزرگتر) قرار داده شده بود، فیلتر می گردد. به تدریج، با فیلتراسیون مکرر، محلول شفاف زرد رنگ به دست آمد. در محلول فیلتر شده، همراه با کلرات سدیم، مقداری هیپوکلریت سدیم نیز وجود دارد. به همین دلیل محلول را تا رسیدن به نقطه جوش حرارت می دهند و حدود 15 دقیقه در آن دما نگه می دارند. در این مرحله، بیشتر هیپوکلریت سدیم به کلرات سدیم تبدیل می شود (که اساس روش هیپوکلریتی سنتز کلرات نیز می باشد). بعد از 15 دقیقه حرارت دادن، pH محلول را بررسی کرده و مقداری محلول هیدروکسید سدیم اضافه کنید تا PH به 8 نزدیک شود. با 350 گرم کلرید سدیم، می توان حدود 627 گرم کلرات سدیم به دست آورد که فقط در تئوری امکان پذیر است (بازده این نوع سلول های خانگی عمدتاً حدود 50٪ است).
مثلا اگر از 60 میلی لیتر محلول فیلتر شده استفاده کنید، از نظر تئوری می تواند محتوی 37.2 گرم کلرات سدیم باشد. با در نظر گرفتن این مقدار، مقدار کلرید پتاسیم مورد نیاز برای واکنش تبادل یونی برابر با 26.1 گرم است. بعد از اضافه کردن کلرید پتاسیم مقدار کمی کاملا حل نمی شود، بنابراین مقداری آب اضافه می کنند تا کاملا حل شود. پس از آن محلول تا دمای اتاق خنک می شود و سپس تا دمای 0 درجه سانتی گراد ادامه می یابد. بلورهای کلرات پتاسیم در کف بشر با محلول سرد شده تشکیل میشوند. پس از فیلتراسیون و خشک شدن، جرم کلرات پتاسیم 10.8 گرم می باشد.


