با اشتراک در خبرنامه همیشه از آخرین تخفیفات و رویدادهای مهم ما مطلع خواهید شد
پتاسیم کلرات KClO3
کلرات پتاسیم یک ترکیب معدنی است که حاوی یک اتم پتاسیم، سه اتم اکسیژن و یک اتم عناصر کلر است. در دمای اتاق در حالت خالص به صورت پودر کریستالی سفید ظاهر می شود. به آن جعبه گلدانی نیز می گویند و با نام های تجاری فگابیت یا فکابیت نیز شناخته می شود. در اواخر قرن هجدهم توسط شیمیدان فرانسوی کلود لوئیس برتوله کشف شد. در آن زمان عمدتاً در آتش بازی استفاده می شد اما به دلایل ایمنی نقش کلرات پتاسیم در آتش بازی تقریباً به پایان رسیده است. در حال حاضر استفاده از کلرات پتاسیم در آتش بازی در اکثر کشورها ممنوع است.
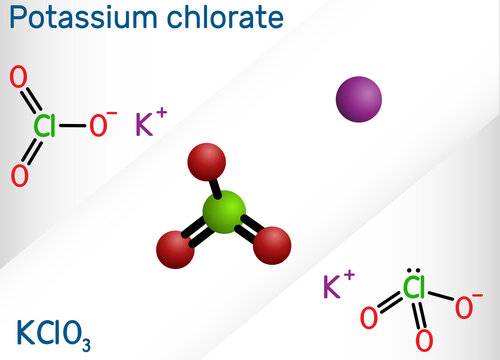
فرمول مولکولی کلرات پتاسیم KClO3 است. دارای کاتیون پتاسیم و آنیون کلرات است که در فرمول ساختاری آن نیز در زیر نشان داده شده است. کلرات پتاسیم دارای خواص فیزیکی و شیمیایی زیر است:
در شکل خالص آن یک جامد کریستالی سفید رنگ است.
جرم مولی آن 122.55 گرم بر مول است.
چگالی آن 2.32 گرم بر سانتی متر مکعب است.
نقطه ذوب آن 356 ℃ است.
نقطه جوش آن 400 درجه است.
در آب محلول است. با افزایش دما، حلالیت کلرات پتاسیم در آب نیز افزایش می یابد.
در گلیسرول نیز محلول است.
در استون و آمونیاک مایع نیز کمی محلول است.
خواص اکسید کننده آن آن را برای احتراق مناسب می کند.
دارای خاصیت رطوبت سنجی است.
ساختار کریستالی آن مونوکلینیک است.
کلرات پتاسیم اگر در حضور کاتالیزوری مانند MnO2 حرارت داده شود بلافاصله تجزیه می شود. واکنش در زیر آورده شده است:
اگر در غیاب کاتالیزور گرم شود، پس از تجزیه پرکلرات پتاسیم و کلرید پتاسیم می دهد. واکنش در زیر آورده شده است.
با گرم شدن بیشتر، پرکلرات پتاسیم به اکسیژن و کلرید پتاسیم تجزیه می شود. واکنش به شرح زیر است.
کلرات پتاسیم رایج ترین کلرات مورد استفاده در صنایع است. با توجه به کاربردهای مختلف آن در صنایع در مقیاس وسیع تولید می شود. برای تولید در مقیاس بزرگ خود از فرآیند لیبیگ در صنایع استفاده می شود.
فرآیند لیبیگ – در این فرآیند کلرات پتاسیم با عبور کلر به هیدروکسید کلسیم داغ و سپس افزودن کلرید پتاسیم به آن تولید میشود. واکنش های مربوطه در زیر آورده شده است -
سایر روش های تهیه کلرات پتاسیم به شرح زیر است:
روش الکترولیز - کلرات پتاسیم را می توان با الکترولیز کلرید پتاسیم نیز تولید کرد. در این روش جنس آند از کربن (گرافیت)، پلاتین یا اکسید فلزی مخلوط و جنس کاتد تیتانیوم اتحاب می شود. هر دو الکترود در محلول آبی کلرید پتاسیم قرار می گیرند و جریانی از آن عبور می کند. با پیشرفت واکنش، کلرات پتاسیم رسوب می کند. پس از انجام الکترولیز، می توانید به راحتی بلورها یا رسوب کلرات پتاسیم را با برداشتن الکترودها از سلول و سپس فیلتر کردن محتویات سلول به دست آورید.
روش عدم تناسب – برای تولید کلرات پتاسیم در مقادیر کم از روش نامتناسب سازی استفاده می شود. در این روش، کلرید سدیم و کلرات سدیم از عدم تناسب هیپوکلریت سدیم تشکیل میشوند. سپس کلرات سدیم تحت واکنش متاتز با کلرید پتاسیم قرار می گیرد. واکنش های مربوطه در زیر آورده شده است
پتاس سوز آور - کلرات پتاسیم همچنین می تواند با عبور گاز کلر به محلول داغ هیدروکسید پتاسیم تولید شود. واکنش در زیر آورده شده است:
موارد استفاده از کلرات پتاسیم
در ابتدا از کلرات پتاسیم در صنعت آتش بازی استفاده می شد تا رنگ های زیبایی به آتش بازی بدهد. از آنجایی که یک عامل اکسید کننده قوی است، در هنگام تجزیه اکسیژن تولید می کند. این به احتراق آتش بازی کمک می کند. این مقدار زیاد گرما الکترون ها را تحریک می کند و آنها رنگ های زیبایی را در مخلوط آتش بازی تولید می کنند. اما به زودی کلرات پتاسیم به دلیل خاصیت انفجاری در فعالیت های غیرقانونی مختلف مورد استفاده قرار گرفت. بنابراین، در حال حاضر استفاده از کلرات پتاسیم در آتش بازی در بسیاری از کشورها ممنوع است. به غیر از آتش بازی، کاربردهای متفاوت دیگری نیز دارد. تعداد کمی از آنها در زیر ذکر شده است:
به عنوان یک عامل اکسید کننده استفاده می شود.
در تهیه اکسیژن استفاده می شود.
می توان از آن به عنوان ضد عفونی کننده استفاده کرد.
در مسابقات ایمنی به مقدار بسیار کم استفاده می شود.
در مواد منفجره استفاده می شود.
به رسیدن زودهنگام مرحله شکوفایی درختان لانگان کمک می کند. بنابراین باعث تولید میوه در آب و هوای گرمتر می شود.
این در سلاح گرم و کلاه ضربی استفاده می شود.
در پیشرانه های موشکی استفاده می شود.
در ترکیب با فولمینات نقره در سازندگان نویز ترفند مانند snappers، pop – it، bang – snaps و غیره استفاده می شود.
از آن در مواد آتش نشانی استفاده می شود.
در نارنجک های دودزا استفاده می شود.
در آزمایشگاه ها نیز استفاده می شود.
در شمع های کلرات یا شمع های اکسیژن استفاده می شود.
در سیستم های تامین اکسیژن هواپیماها، ایستگاه های فضایی و زیردریایی ها و غیره استفاده می شود.
از آن در نورپردازی های برجسته (نوعی نورپردازی صحنه که در قدیم در سالن های تئاتر و موسیقی استفاده می شد) نیز استفاده می شود.
از آن به عنوان آفت کش نیز استفاده می شود.
کلرات پتاسیم مذاب در نوزادان ژله ای با جیغ دراماتیک، خرس صمغی، آب نبات هاریبو و ترولی و غیره استفاده می شود.
کلرات پتاسیم کاربردهای زیادی دارد و یک ماده شیمیایی بسیار مفید برای بسیاری از صنایع است، اما از خواص انفجاری یا اکسید کننده آن در فعالیت های غیرقانونی و غیرانسانی استفاده می شود. در افغانستان برای تولید مواد منفجره دست ساز که در بسیاری از فعالیت های غیرانسانی استفاده می شود، استفاده می شود. این ماده اصلی در بمب گذاری خودروی بمب گذاری شده در سال 2002 بالی (تایلند) بود که باعث کشته شدن 202 نفر شد.
فرمول مولکولی کلرات پتاسیم KClO3 است. دارای کاتیون پتاسیم و آنیون کلرات است که در فرمول ساختاری آن نیز در زیر نشان داده شده است. کلرات پتاسیم دارای خواص فیزیکی و شیمیایی زیر است:
در شکل خالص آن یک جامد کریستالی سفید رنگ است.
جرم مولی آن 122.55 گرم بر مول است.
چگالی آن 2.32 گرم بر سانتی متر مکعب است.
نقطه ذوب آن 356 ℃ است.
نقطه جوش آن 400 درجه است.
در آب محلول است. با افزایش دما، حلالیت کلرات پتاسیم در آب نیز افزایش می یابد.
در گلیسرول نیز محلول است.
در استون و آمونیاک مایع نیز کمی محلول است.
خواص اکسید کننده آن آن را برای احتراق مناسب می کند.
دارای خاصیت رطوبت سنجی است.
ساختار کریستالی آن مونوکلینیک است.

کلرات پتاسیم اگر در حضور کاتالیزوری مانند MnO2 حرارت داده شود بلافاصله تجزیه می شود. واکنش در زیر آورده شده است:
2KClO3(s) 🡪 3O2(g) + 2KCl(s)
اگر در غیاب کاتالیزور گرم شود، پس از تجزیه پرکلرات پتاسیم و کلرید پتاسیم می دهد. واکنش در زیر آورده شده است.
4KClO3 🡪 3KClO4 + KCl
با گرم شدن بیشتر، پرکلرات پتاسیم به اکسیژن و کلرید پتاسیم تجزیه می شود. واکنش به شرح زیر است.
KClO4 🡪 KCl + 2O2
کلرات پتاسیم رایج ترین کلرات مورد استفاده در صنایع است. با توجه به کاربردهای مختلف آن در صنایع در مقیاس وسیع تولید می شود. برای تولید در مقیاس بزرگ خود از فرآیند لیبیگ در صنایع استفاده می شود.
فرآیند لیبیگ – در این فرآیند کلرات پتاسیم با عبور کلر به هیدروکسید کلسیم داغ و سپس افزودن کلرید پتاسیم به آن تولید میشود. واکنش های مربوطه در زیر آورده شده است -
6Ca(OH)2 + 6Cl2 🡪 Ca(ClO3)2 + 5CaCl2 + 6H2O
Ca(ClO3)2 + 2KCl 🡪 2KClO3 + CaCl2
سایر روش های تهیه کلرات پتاسیم به شرح زیر است:
روش الکترولیز - کلرات پتاسیم را می توان با الکترولیز کلرید پتاسیم نیز تولید کرد. در این روش جنس آند از کربن (گرافیت)، پلاتین یا اکسید فلزی مخلوط و جنس کاتد تیتانیوم اتحاب می شود. هر دو الکترود در محلول آبی کلرید پتاسیم قرار می گیرند و جریانی از آن عبور می کند. با پیشرفت واکنش، کلرات پتاسیم رسوب می کند. پس از انجام الکترولیز، می توانید به راحتی بلورها یا رسوب کلرات پتاسیم را با برداشتن الکترودها از سلول و سپس فیلتر کردن محتویات سلول به دست آورید.
روش عدم تناسب – برای تولید کلرات پتاسیم در مقادیر کم از روش نامتناسب سازی استفاده می شود. در این روش، کلرید سدیم و کلرات سدیم از عدم تناسب هیپوکلریت سدیم تشکیل میشوند. سپس کلرات سدیم تحت واکنش متاتز با کلرید پتاسیم قرار می گیرد. واکنش های مربوطه در زیر آورده شده است
3NaOCl(aq) 🡪 2NaCl(s) + NaClO3(aq)
KCl(aq) + NaClO3 (aq) 🡪 NaCl(aq) + KClO3(s)
پتاس سوز آور - کلرات پتاسیم همچنین می تواند با عبور گاز کلر به محلول داغ هیدروکسید پتاسیم تولید شود. واکنش در زیر آورده شده است:
3Cl2(g) + 6KOH(aq) 🡪 KClO3(aq) + 5KCl(aq) + 3H2O(l)

موارد استفاده از کلرات پتاسیم
در ابتدا از کلرات پتاسیم در صنعت آتش بازی استفاده می شد تا رنگ های زیبایی به آتش بازی بدهد. از آنجایی که یک عامل اکسید کننده قوی است، در هنگام تجزیه اکسیژن تولید می کند. این به احتراق آتش بازی کمک می کند. این مقدار زیاد گرما الکترون ها را تحریک می کند و آنها رنگ های زیبایی را در مخلوط آتش بازی تولید می کنند. اما به زودی کلرات پتاسیم به دلیل خاصیت انفجاری در فعالیت های غیرقانونی مختلف مورد استفاده قرار گرفت. بنابراین، در حال حاضر استفاده از کلرات پتاسیم در آتش بازی در بسیاری از کشورها ممنوع است. به غیر از آتش بازی، کاربردهای متفاوت دیگری نیز دارد. تعداد کمی از آنها در زیر ذکر شده است:
به عنوان یک عامل اکسید کننده استفاده می شود.
در تهیه اکسیژن استفاده می شود.
می توان از آن به عنوان ضد عفونی کننده استفاده کرد.
در مسابقات ایمنی به مقدار بسیار کم استفاده می شود.
در مواد منفجره استفاده می شود.
به رسیدن زودهنگام مرحله شکوفایی درختان لانگان کمک می کند. بنابراین باعث تولید میوه در آب و هوای گرمتر می شود.
این در سلاح گرم و کلاه ضربی استفاده می شود.
در پیشرانه های موشکی استفاده می شود.
در ترکیب با فولمینات نقره در سازندگان نویز ترفند مانند snappers، pop – it، bang – snaps و غیره استفاده می شود.
از آن در مواد آتش نشانی استفاده می شود.
در نارنجک های دودزا استفاده می شود.
در آزمایشگاه ها نیز استفاده می شود.
در شمع های کلرات یا شمع های اکسیژن استفاده می شود.
در سیستم های تامین اکسیژن هواپیماها، ایستگاه های فضایی و زیردریایی ها و غیره استفاده می شود.
از آن در نورپردازی های برجسته (نوعی نورپردازی صحنه که در قدیم در سالن های تئاتر و موسیقی استفاده می شد) نیز استفاده می شود.
از آن به عنوان آفت کش نیز استفاده می شود.
کلرات پتاسیم مذاب در نوزادان ژله ای با جیغ دراماتیک، خرس صمغی، آب نبات هاریبو و ترولی و غیره استفاده می شود.
کلرات پتاسیم کاربردهای زیادی دارد و یک ماده شیمیایی بسیار مفید برای بسیاری از صنایع است، اما از خواص انفجاری یا اکسید کننده آن در فعالیت های غیرقانونی و غیرانسانی استفاده می شود. در افغانستان برای تولید مواد منفجره دست ساز که در بسیاری از فعالیت های غیرانسانی استفاده می شود، استفاده می شود. این ماده اصلی در بمب گذاری خودروی بمب گذاری شده در سال 2002 بالی (تایلند) بود که باعث کشته شدن 202 نفر شد.


