با اشتراک در خبرنامه همیشه از آخرین تخفیفات و رویدادهای مهم ما مطلع خواهید شد
منگنز و کاربردهای آن
منگنز (Mn)، عنصر شیمیایی، یکی از فلزات سفید نقره ای، سخت و شکننده از گروه 7 (VIIb) جدول تناوبی. در سال 1774 توسط شیمیدان سوئدی کارل ویلهلم شیله هنگام کار با ماده معدنی پیرولوزیت به عنوان یک عنصر شناخته شد و در همان سال توسط همکار او، یوهان گوتلیب گان، جدا شد. اگرچه منگنز به ندرت به صورت خالص استفاده می شود، اما منگنز برای فولادسازی ضروری است.
ویژگی های عنصر
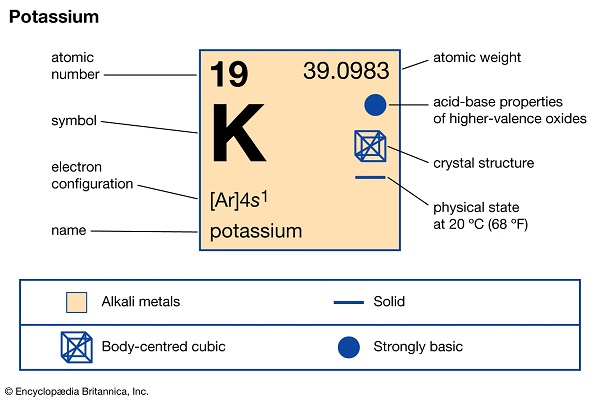
عدد اتمی 25
وزن اتمی 54.938
نقطه ذوب 1246 درجه سانتیگراد (2275 درجه فارنهایت)
نقطه جوش 2062 درجه سانتیگراد (3744 درجه فارنهایت)
چگالی 7.21-7.44 گرم بر سانتی متر مکعب در 20 درجه سانتی گراد (68 درجه فارنهایت)
حالت های اکسیداسیون +2، +3، +4، +5، +6، +7
پیکربندی الکترون
[Ar]3d54s2
پیدایش، کاربردها و خواص
منگنز همراه با عناصر دیگر به طور گسترده در پوسته زمین یافت می شود. منگنز از نظر فراوانی در پوسته زمین پس از آهن در میان عناصر انتقالی دوم است. از نظر خواص فیزیکی و شیمیایی تقریباً شبیه آهن است اما سخت تر و شکننده تر است. ذخایر قابل توجهی از منگنز وجود دارد که مهمترین کانسنگ (عمدتاً اکسید) عمدتاً از دی اکسید منگنز (MnO2) به شکل پیرولوزیت، رومانشیت و واد تشکیل شده است. منگنز برای رشد گیاهان ضروری است و در جذب نیترات در گیاهان سبز و جلبک ها نقش دارد. کمبود منگنز باعث آتروفی بیضه می شود. بیش از حد این عنصر در گیاهان و حیوانات سمی است.
کانسنگ منگنز عمدتا در استرالیا، آفریقای جنوبی، چین، گابن و برزیل تولید می شود. مناطق وسیعی از کف اقیانوس با گره های منگنز پوشیده شده است که به آنها گره های چند فلزی نیز می گویند.
بیشتر منگنز تولید شده به شکل فرومنگنز و آلیاژهای سیلیکومنگنز برای تولید آهن و فولاد استفاده می شود. کانسنگ منگنز حاوی اکسیدهای آهن، ابتدا در کوره های بلند یا کوره های الکتریکی با کربن احیا می شود تا فرومنگنز تولید شود که به نوبه خود در فولادسازی استفاده می شود. افزودن منگنز که تمایل بیشتری به گوگرد نسبت به آهن دارد، سولفید آهن کم ذوب در فولاد را به سولفید منگنز با ذوب بالا تبدیل می کند. فولادی که بدون منگنز تولید می شود، هنگام نورد گرم یا آهنگری تجزیه می شود. فولادها معمولاً کمتر از 1 درصد منگنز دارند. فولاد منگنز برای خدمات بسیار ناهموار استفاده می شود. حاوی 11 تا 14 درصد منگنز، سطحی سخت، مقاوم در برابر سایش و خود تجدید شونده را بر روی یک هسته نشکن سخت ایجاد می کند. منگنز خالص تولید شده به صورت الکترولیتی بیشتر در تهیه آلیاژهای غیرآهنی مس، آلومینیوم، منیزیم و نیکل و در تولید مواد شیمیایی با خلوص بالا استفاده می شود. عملاً تمام آلیاژهای تجاری آلومینیوم و منیزیم حاوی منگنز برای بهبود مقاومت در برابر خوردگی و خواص مکانیکی هستند. قوطی های آلومینیومی حاوی حدود 1.5 درصد منگنز هستند.
تمام منگنز طبیعی، ایزوتوپ پایدار منگنز-55 است. این در چهار تغییر آلوتروپیک وجود دارد. ساختار مکعبی پیچیده فاز به اصطلاح آلفا شکلی است که در دماهای معمولی پایدار است. منگنز از نظر فعالیت شیمیایی عمومی تا حدودی شبیه آهن است. این فلز به طور سطحی در هوا اکسید می شود و در هوای مرطوب زنگ می زند. در هوا یا اکسیژن در دمای بالا می سوزد، مانند آهن. آب را به آرامی در هنگام سرد و به سرعت در هنگام گرم شدن تجزیه می کند. و به آسانی در اسیدهای معدنی رقیق با تشکیل هیدروژن و نمک های مربوطه در حالت اکسیداسیون +2 حل می شود.
منگنز کاملاً الکترومثبت است و به راحتی در اسیدهای غیر اکسید کننده رقیق حل می شود. اگرچه در دمای اتاق نسبت به غیرفلزات نسبتاً غیر فعال است، اما در دماهای بالا با بسیاری از آنها واکنش نشان می دهد. بنابراین، منگنز در کلر می سوزد و کلرید منگنز (II) (MnCl2) می دهد، با فلوئور واکنش می دهد و فلوراید منگنز (II) (MnF2) و منگنز (III) فلوراید (MnF3) می دهد، در نیتروژن در حدود 1200 درجه سانتی گراد می سوزد (2،20). °F) برای دادن نیترید منگنز (II) (Mn3N2) و سوختن در اکسیژن برای تولید اکسید منگنز (II,III) (Mn3O4). منگنز همچنین مستقیماً با بور، کربن، گوگرد، سیلیکون یا فسفر ترکیب می شود اما با هیدروژن ترکیب نمی شود.
ترکیبات
از بین طیف گسترده ای از ترکیبات تشکیل شده توسط منگنز، پایدارترین آنها در حالت های اکسیداسیون +2، +6 و +7 رخ می دهد. اینها به ترتیب با نمک های منگنه (با منگنز به عنوان یون Mn2+)، منگنات ها (MnO42-)، و پرمنگنات ها (MnO4-) مثال می زنند. همانطور که در مورد تیتانیوم، وانادیوم و کروم، بالاترین حالت اکسیداسیون (7+) منگنز مربوط به تعداد کل الکترون های 3d و 4s است. این حالت فقط در گونه های اکسو پرمنگنات (MnO4-)، هپتوکسید منگنز (Mn2O7)، و تری اکسید منگنز فلوراید (MnO3F) رخ می دهد، که شباهت هایی به ترکیبات مربوطه هالوژن ها نشان می دهد - به عنوان مثال، در ناپایداری اکسید. منگنز در حالت اکسیداسیون +7 به شدت اکسید کننده است و معمولاً در حالت +2 به منگنز کاهش می یابد. حالت های اکسیداسیون میانی شناخته شده اند، اما، به جز برخی از ترکیبات در حالت های +3 و +4، اهمیت خاصی ندارند.
ترکیبات صنعتی اصلی منگنز شامل چندین اکسید است. اکسید منگنز (II) یا مونوکسید منگنز (MnO) به عنوان ماده اولیه برای تولید نمک های منگنز، به عنوان یک افزودنی در کودها و به عنوان یک معرف در چاپ پارچه استفاده می شود. در طبیعت به عنوان منگنوزیت معدنی سبز وجود دارد. همچنین می توان آن را به صورت تجاری با حرارت دادن کربنات منگنز در غیاب هوا یا با عبور هیدروژن یا مونوکسید کربن از روی دی اکسید منگنز تهیه کرد.
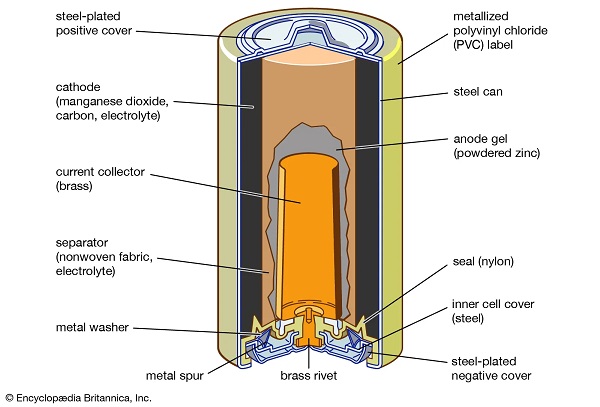
مهمترین ترکیب منگنز دی اکسید منگنز است که در آن منگنز در حالت اکسیداسیون +4 قرار دارد و ماده معدنی سیاه پیرولوزیت منبع اصلی منگنز و تمام ترکیبات آن است. همچنین به طور گسترده ای به عنوان یک اکسیدان شیمیایی در سنتز آلی استفاده می شود. دی اکسید منگنز به عنوان ماده کاتدی در باتری های سلول خشک استفاده می شود. این به طور مستقیم از سنگ معدن تولید می شود، اگرچه مقادیر قابل توجهی نیز به صورت مصنوعی تهیه می شود. اکسید مصنوعی از تجزیه نیترات منگنوز تهیه می شود. با واکنش سولفات منگنوز، اکسیژن و هیدروکسید سدیم. یا با الکترولیز محلول آبی سولفات منگنز.
نمک های مختلف منگنز نیز اهمیت تجاری دارند. سولفات منگنز (MnSO4) به خاک اضافه می شود تا رشد گیاه را به ویژه مرکبات تقویت کند. علاوه بر این، یک عامل کاهنده خوب است، به ویژه در ساخت خشک کن های رنگ و لاک مفید است. ترکیب پرمنگنات پتاسیم با رنگ بنفش تیره (KMnO4) کاربردهای زیادی دارد که مهمترین آنها به عنوان ضدعفونی کننده، تصفیه کننده آب و ضد عفونی کننده است.


