با اشتراک در خبرنامه همیشه از آخرین تخفیفات و رویدادهای مهم ما مطلع خواهید شد
نیترات آمونیوم و کاربردهای آن
نیترات آمونیوم یک ترکیب شیمیایی با فرمول NH4NO3 است. یک نمک کریستالی سفید است که از یون های آمونیوم و نیترات تشکیل شده است. این ماده در آب بسیار محلول است و به عنوان یک جامد رطوبت سنجی است، اگرچه هیدرات تشکیل نمی دهد. این کود عمدتاً در کشاورزی به عنوان کود با نیتروژن بالا استفاده می شود.
کاربرد عمده دیگر آن به عنوان جزئی از مخلوط های منفجره مورد استفاده در معادن، استخراج معادن و ساخت و سازهای عمرانی است. نیترات آمونیوم ماده اصلی تشکیل دهنده ANFO است، یک ماده منفجره صنعتی محبوب که 80 درصد مواد منفجره مورد استفاده در آمریکای شمالی را تشکیل می دهد. فرمول های مشابهی در مواد منفجره دست ساز استفاده شده است.
بسیاری از کشورها به دلیل نگرانی در مورد پتانسیل سوء استفاده از آن، استفاده از آن در برنامه های مصرف کننده را به تدریج کنار می گذارند. انفجارهای تصادفی نیترات آمونیوم هزاران نفر را از اوایل قرن بیستم کشته است. تولید جهانی در سال 2017 21.6 میلیون تن برآورد شده است. تا سال 2021، تولید جهانی نیترات آمونیوم به 16.7 میلیون تن کاهش یافت.
پیدایش
نیترات آمونیوم به عنوان ماده معدنی طبیعی gwihabaite (که قبلاً به عنوان نیترامیت شناخته می شد) تلقی می شود. نخست نیترات آمونیوم در خشک ترین مناطق صحرای آتاکاما در شیلی استخراج میشد تا اینکه فرآیند هابر-بوش سنتز نیتراتها را از نیتروژن اتمسفر امکان پذیر کرد.
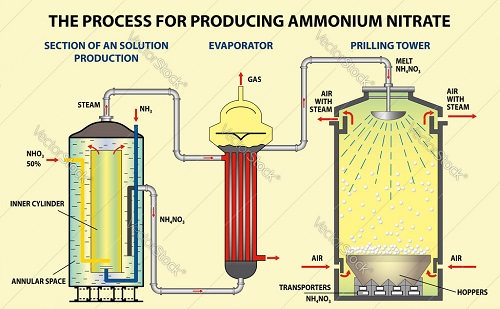
تولید
تولید صنعتی نیترات آمونیوم مستلزم واکنش اسید-باز آمونیاک با اسید نیتریک است:
HNO3 + NH3 → NH4NO3
آمونیاک مورد نیاز برای این فرآیند توسط فرآیند هابر از نیتروژن و هیدروژن به دست می آید. آمونیاک تولید شده توسط فرآیند هابر می تواند توسط فرآیند Ostwald به اسید نیتریک اکسید شود. آمونیاک به شکل بی آب آن (گاز) استفاده می شود و اسید نیتریک غلیظ است. این واکنش به دلیل ماهیت بسیار گرمازای آن به شدیدا انرژی زاست. پس از تشکیل محلول، معمولاً در غلظت 83 درصد، آب اضافی تبخیر میشود تا محتوای نیترات آمونیوم (AN) با غلظت 95 تا 99.9 درصد (مذاب AN)، بسته به درجه، باقی بماند. سپس مذاب AN در یک برج اسپری به صورت "پریل" یا دانه های کوچک یا با پاشیدن و چرخاندن در یک درام چرخان به دانه هایی تبدیل می شود. دانه ها یا دانه ها را می توان بیشتر خشک کرد، خنک کرد و سپس برای جلوگیری از کیک شدن پوشش داد. این دانه ها یا گرانول ها محصولات معمولی AN در تجارت هستند.
روش دیگر تولید، نوعی از فرآیند نیتروفسفات است:
Ca(NO3)2 + 2 NH3 + CO2 + H2O → 2 NH4NO3 + CaCO3
محصولات، کربنات کلسیم و نیترات آمونیوم، ممکن است به طور جداگانه خالص شوند یا به صورت ترکیبی به عنوان نیترات کلسیم آمونیوم فروخته شوند.
نیترات آمونیوم همچنین می تواند از طریق واکنش های متاتز ساخته شود.
(NH4)2SO4 + Ba(NO3)2 → 2 NH4NO3 + BaSO4
(NH4)2SO4 + Ca(NO3)2 → 2 NH4NO3 + CaSO4
NH4Cl + AgNO3 → NH4NO3 + AgCl
واکنش ها
از آنجایی که نیترات آمونیوم یک نمک است، هر دو کاتیون NH4+ و آنیون، NO3- ممکن است در واکنش های شیمیایی شرکت کند.
نیترات آمونیوم جامد در دمای کمتر از حدود 300 درجه سانتیگراد تجزیه شده و اکسید نیتروژن و آب تولید می کند:
NH4NO3 → N2O + 2 H2O
در دماهای بالاتر، واکنش زیر غالب است.
2 NH4NO3 → 2 N2 + O2 + 4 H2O
هر دو واکنش تجزیه گرمازا و محصولات آنها گاز است. تحت شرایط خاصی، این میتواند منجر به یک واکنش فراری شود که فرآیند تجزیه را تبدیل به انفجار کند.
کاربردها
کود
نیترات آمونیوم یک کود مهم با امتیاز NPK 34-0-0 (34 درصد نیتروژن) است. غلظت نیتروژن کمتری نسبت به اوره (46-0-0) دارد. مزیت نیترات آمونیوم نسبت به اوره این است که پایدارتر است و نیتروژن را به سرعت در جو از دست نمی دهد.
مواد منفجره
نیترات آمونیوم وقتی با مواد منفجره مانند TNT یا با سوخت هایی مانند پودر آلومینیوم یا نفت کوره ترکیب می شود، به راحتی مخلوط های انفجاری با خواص متفاوت را تشکیل می دهد. نمونه هایی از مواد منفجره حاوی نیترات آمونیوم عبارتند از:
آماتکس (نیترات آمونیوم، TNT و RDX)
آماتول (نیترات آمونیوم و TNT)
آمونال (نیترات آمونیوم و پودر آلومینیوم)
ANFO (نیترات آمونیوم و نفت کوره)
آسترولیت (نیترات آمونیوم و سوخت موشک هیدرازین)
گوما-2 (نیترات آمونیوم، نیتروگلیکول، نیتروسلولز، دی بوتیل فتالات و سوخت)
مینول (منفجره) (نیترات آمونیوم، TNT و پودر آلومینیوم)
نیترولیت (نیترات آمونیوم، TNT و نیتروگلیسیرین +)
DBX (نیترات آمونیوم، RDX، TNT و پودر آلومینیوم)
Tovex (نیترات آمونیوم و نیترات متیل آمونیوم)
مخلوط با نفت کوره

آنفوANFO
مخلوطی از 94٪ نیترات آمونیوم ("AN") و 6٪ نفت کوره ("FO") است که به طور گسترده به عنوان یک ماده منفجره صنعتی فله استفاده می شود. مزیتهای هزینه کم، ایمنی نسبی و سهولت استفاده ANFO بیشتر از مزایای ارائه شده توسط مواد منفجره صنعتی معمولی مانند مقاومت در برابر آب، تعادل اکسیژن، سرعت انفجار بالا و عملکرد در قطرهای کوچک اهمیت دارد.
تروریسم
مواد منفجره مبتنی بر نیترات آمونیوم در بمبگذاری استرلینگ هال در مدیسون، ویسکانسین، 1970، بمبگذاری اوکلاهما سیتی در سال 1995، بمبگذاری سال 2011 دهلی، بمبگذاری سال 2011 در اسلو، و انفجار 2013 حیدرآباد استفاده شد.
پتانسیل استفاده از این ماده به عنوان ماده منفجره، اقدامات نظارتی را برانگیخته است. به عنوان مثال، در استرالیا، مقررات کالاهای خطرناک در آگوست 2005 برای اجرای مجوز در برخورد با چنین موادی اجرایی شد. مجوزها فقط به متقاضیان (صنعت) با تدابیر امنیتی مناسب برای جلوگیری از هرگونه سوء استفاده اعطا می شود. استفادههای اضافی مانند اهداف آموزشی و تحقیقاتی نیز ممکن است در نظر گرفته شود، اما استفاده فردی مجاز نخواهد بود. کارمندان افرادی که مجوز برخورد با این ماده را دارند همچنان باید توسط پرسنل مجاز نظارت شوند و قبل از اعطای مجوز باید یک بازرسی امنیتی و پلیس ملی را پشت سر بگذارند.
ایمنی، جابجایی و ذخیره سازی
نیترات آمونیوم خالص نمی سوزد، اما به عنوان یک اکسید کننده قوی، احتراق مواد آلی (و برخی غیر آلی) را پشتیبانی و تسریع می کند. نباید در نزدیکی مواد قابل احتراق نگهداری شود. در حالی که نیترات آمونیوم در بسیاری از شرایط در دما و فشار محیط پایدار است، ممکن است از یک بار شروع قوی منفجر شود. نباید در نزدیکی مواد منفجره قوی یا مواد انفجاری نگهداری شود.
نیترات آمونیوم مذاب به شوک و انفجار بسیار حساس است، به ویژه اگر با مواد ناسازگار مانند مواد قابل احتراق، مایعات قابل اشتعال، اسیدها، کلرات ها، کلریدها، گوگرد، فلزات، زغال چوب و خاک اره آلوده شود.
تماس با مواد خاصی مانند کلرات ها، اسیدهای معدنی و سولفیدهای فلزی، می تواند منجر به تجزیه شدید شود که می تواند مواد قابل احتراق مجاور را مشتعل کند یا منفجر شود.
نیترات آمونیوم پس از ذوب شروع به تجزیه می کند و NOx، HNO3، NH آزاد می کند.
نیترات آمونیوم دارای رطوبت نسبی بحرانی 59.4 درصد در دمای 30 درجه سانتیگراد است. در رطوبت بالاتر رطوبت را از جو جذب می کند. بنابراین مهم است که نیترات آمونیوم را در یک ظرف محکم در بسته نگهداری کنید. در غیر این صورت، می تواند به یک توده بزرگ و جامد تبدیل شود. نیترات آمونیوم می تواند رطوبت کافی را برای مایع شدن جذب کند. مخلوط کردن نیترات آمونیوم با برخی کودهای دیگر می تواند رطوبت نسبی بحرانی را کاهش دهد.
خطرات سلامتی
نیترات آمونیوم برای سلامتی خطرناک نیست و معمولاً در محصولات کودی استفاده می شود. نیترات آمونیوم دارای LD50 2217 میلی گرم بر کیلوگرم است که برای مقایسه حدود دو سوم نمک خوراکی است.
بلایا
نیترات آمونیوم به صورت غیر قابل انفجار به گازهای اکسید نیتروژن و بخار آب تجزیه می شود. با این حال، می تواند به صورت انفجاری تجزیه شود. ذخایر بزرگ مواد به دلیل اکسیداسیون بالای آنها می تواند منجر به آتش سوزی وسیعی گردد. وضعیتی که به راحتی می تواند به انفجار تبدیل شود. انفجارها غیر معمول نیستند: حوادث نسبتاً جزئی در بیشتر سال ها رخ می دهد و چندین انفجار بزرگ و ویرانگر نیز رخ داده است. به عنوان مثال می توان به انفجار اوپائو در سال 1921 (یکی از بزرگترین انفجارهای غیرهسته ای مصنوعی)، فاجعه شهر تگزاس در سال 1947، انفجارهای تیانجین در سال 2015 در چین، و انفجار 2020 بیروت اشاره کرد.
نیترات آمونیوم می تواند از طریق دو مکانیسم منفجر شود:
انتقال شوک به داخل یا در تماس با توده نیترات آمونیوم باعث انفجار نیترات آمونیوم می شود. کریوالد، مورگان (سایرویل امروزی، نیوجرسی)، اوپائو و تسندرلو نمونههایی از این بلایا هستند.
انفجار نیترات آمونیوم ناشی از آتشی است که به نیترات آمونیوم گسترش می یابد (تگزاس سیتی، برست؛ غرب، تیانجین؛ بیروت)، یا از مخلوط شدن نیترات آمونیوم با مواد قابل احتراق در طول آتش سوزی (گیبزتاون، چروکی، نادادورس) .


