با اشتراک در خبرنامه همیشه از آخرین تخفیفات و رویدادهای مهم ما مطلع خواهید شد
کلرات چیست؟
برای تهیه پتاسیم کلرات و سایر اکسید کننده ها، به راحتی از سایت فروشگاهی فلات کالا آنلاین خرید کنید.
کلرات نام رایج بنیان ClO− است. سه آنیون که اتم کلر آن در حالت اکسیداسیون 5+ است. این اصطلاح همچنین می تواند به ترکیبات شیمیایی حاوی این آنیون اشاره داشته باشد که کلرات ها نمک های اسید کلریک هستند. سایر اکسیدایونهای کلر را میتوان «کلرات» نامید و به دنبال آن یک عدد رومی در پرانتز نشاندهنده وضعیت اکسیداسیون کلر است: به عنوان مثال، ClO−
چهار یونی که معمولاً پرکلرات نامیده می شود را می توان کلرات (VII) نیز نامید.
همانطور که توسط نظریه دفع جفت الکترون لایه ظرفیتی پیشبینی میشود، آنیونهای کلرات ساختارهای هرمی مثلثی دارند.
کلرات ها اکسید کننده های قوی هستند و باید از مواد آلی یا موادی که به راحتی اکسید می شوند دور نگه داشته شوند. مخلوط نمک های کلرات با تقریباً هر ماده قابل احتراق (قند، خاک اره، زغال چوب، حلال های آلی، فلزات و غیره) به آسانی آتش می گیرد. به همین دلیل، کلرات ها زمانی به طور گسترده در صنایع آتش نشانی استفاده می شدند، اگرچه استفاده از آنها به دلیل ناپایداری آنها کاهش یافته است. بیشتر کاربردهای پیروتکنیک که قبلا از کلرات ها استفاده می کردند، اکنون به جای آن از پرکلرات های پایدارتر استفاده می کنند.
کلرات های فلزی را می توان با افزودن کلر به هیدروکسیدهای فلزی داغ مانند KOH تهیه کرد. در این واکنش، کلر دچار عدم تناسب، هم احیا و هم اکسیداسیون می شود
مقیاس صنعتی برای تولیدکلرات سدیم از محلول آبی کلرید سدیم (آب نمک) به جای گاز کلر استفاده می شود. دمای الکترولیز مابین 50 تا 70 درجه سانتیگراد تنظیم می گردد.
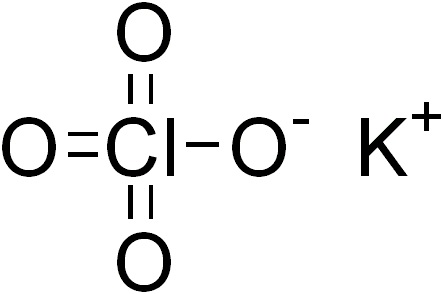
یک مطالعه در سال 2010 وجود ذخایر طبیعی کلرات در سرتاسر جهان را کشف کرد که غلظتهای نسبتاً بالایی در مناطق خشک و فوقخشک یافت میشود. همچنین کلرات در نمونه های بارندگی با مقدار کلرات مشابه پرکلرات اندازه گیری شد. گمان می رود که کلرات و پرکلرات ممکن است یک مکانیسم تشکیل طبیعی مشترک داشته باشند و می توانند بخشی از چرخه بیوژئوشیمی کلر باشند. از نقطه نظر میکروبی، وجود کلرات طبیعی همچنین می تواند توضیح دهد که چرا انواع میکروارگانیسم ها قادر به احیای کلرات به کلرید هستند. علاوه بر این، تکامل احیای کلرات ممکن است یک پدیده باستانی باشد زیرا همه باکتریهای کاهنده پرکلرات که تا به امروز توصیف شدهاند نیز از کلرات به عنوان گیرنده الکترون پایانی استفاده میکنند. باید به وضوح بیان کرد که در حال حاضر هیچ کانی غالب کلرات شناخته شده نیست.
در سال 2011، مطالعه ای در موسسه فناوری جورجیا از وجود کلرات منیزیم در سیاره مریخ پرده برداری کرد. کلرات ها نسبتاً سمی هستند، اگرچه در صورت احیا، کلریدهای بی ضرر را تشکیل می دهند.
نمونه هایی از کلرات ها عبارتند از:
کلرات پتاسیم، KClO3
کلرات سدیم، NaClO3
کلرات منیزیم، Mg(ClO3)2


