با اشتراک در خبرنامه همیشه از آخرین تخفیفات و رویدادهای مهم ما مطلع خواهید شد
کلرات سدیم NaClO3 چیست و چه کاربردی دارد؟
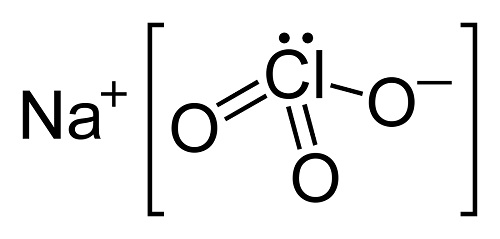
ترکیب کلرات سدیم یک ماده معدنی با فرمول شیمیایی NaClO3 است. از خواص فیزیکی آن می توان به سفید بودن و داشتن طبیعت کریستالی اشاره کرد که به سرعت در آب حل می شود. طبیعتاً به عنوان هیگروسکوپیک (جذب رطوبت از هوا) شناخته شده است. در دمای بیش از 573 کلوین تجزیه می شود تا O2 را تخلیه کند و NaCl را برجای بگذارد. سالانه مقدار زیادی کلرات سدیم تولید می شود که بیشتر برای مصارف مختلف خصوصا به عنوان اکسید کننده در صنایع کاغذسازی جهت تولید کاغذ با کیفیت بالا به کار می رود.
خواص فیزیکی کلرات سدیم
یک ترکیب بی بو است.
رنگ آن از زرد روشن تا جامد کریستالی سفید متفاوت است.
بسیار محلول در آب و سنگین تر از آب است. از این رو، می تواند با سرعت زیادی غرق شود و تجزیه شود.
در حالی که به خودی خود یک ماده منفجره نیست، اما در تماس با آب می تواند باعث احتراق قوی شود. باعث واکنش شدید گرمازا می شود. حتی اگر 30 درصد مولکول ها در آب باشند، به دلیل خواص ذاتی خود می توانند یک واکنش اکسید کننده قوی ایجاد کنند.
چگالی آن 2.49 گرم بر سانتی متر است.
نقطه جوش کلرات سدیم 300 درجه سانتیگراد و نقطه ذوب 248 درجه سانتیگراد است.
همچنین در برخی از حلال های آلی مانند گلیسرول و متانول کاملا محلول و مقدار کمی در استون محلول است.
ساختار کریستالی مکعبی دارد.
خواص شیمیایی کلرات سدیم
یک عامل اکسید کننده قوی است. یون هیپوکلریت به اکسید شدن و سفید شدن هر ماده شیمیایی کمک می کند.
ظرفیت حرارتی آن 104.6 Jmol/K است.
واکنش آن با برومید پتاسیم و اسید کلریدریک محصولاتی مانند کلرید پتاسیم، کلرید سدیم، برم و آب به دست میدهد.
واکنش شیمیایی آن با یدید پتاسیم و اسید کلریدریک باعث تولید محصولاتی مانند کلرید سدیم، کلرید پتاسیم، ید و آب می شود.
می تواند با بسیاری از ترکیبات شیمیایی مختلف مانند سایر برومیدها و اسیدها واکنش نشان دهد. هنگامی که در تماس نزدیک با چوب، یا هر ماده مشابه دیگری مانند اسید سولفوریک، فلزات مختلف و مواد مصنوعی مختلف قرار می گیرد، ممکن است باعث شعله و انفجار شود.
به دلیل خاصیت انفجاری ناشی از ماهیت اکسید کننده بالا، به طور جداگانه نگهداری می شود و در محیط کنترل شده استفاده می شود.

تهیه سدیم کلرات
کلرات سدیم از الکترولیز آب شور ساده (کلرید سدیم و آب) تولید می شود.
این فرآیند در طبیعت گرمازا است. در چند مرحله رخ می دهد. همچنین، تغییرات pH و دما در تولید آن موثر است.
تهیه کلرات سدیم بسیار ساده است، گاز کلر (Cl2) در آند و گاز هیدروژن (H2) در کاتد ذخیره می شود. سپس کلر در سلول به یک گروه آنیون هیپوکلریت هیدرولیز می شود که در آن نقطه کلرات سدیم تولید می کند.
ذرات کلرات سدیم به شکل کریستال تشکیل می شوند. محلول به دست آمده پس از هیدرولیز اغلب مایع سلولی نامیده می شود. سپس محلول از دستگاه خارج می شود. کریستال های به دست آمده شسته و خشک می شوند و سپس در یک منطقه خشک نگهداری می شوند. بسته به کاربرد، ممکن است به صورت کریستال یا مایع فروخته شود.
موارد مصرف کلرات سدیم
جهت ساخت علف کش ها، مواد منفجره، رنگ ها، کبریت ها، جوهرها، زیباکننده ها، داروها، برگ زدایی ها، کاغذ و پوست گوساله استفاده می شود.
به عنوان پوره در صنعت ساخت کاغذ استفاده می شود.
در فرآیند Solvay استفاده می شود
به عنوان یک اکسید کننده در فرآیندهای رنگ سازی در مقیاس بزرگ و سفید کننده استفاده می شود.
در زمینه پزشکی برای تهیه داروهای مختلف استفاده می شود.
در ساخت کودها و مواد منفجره استفاده می شود.
با حرارت دادن، کلرات سدیم به کلرید سدیم (جامد) و اکسیژن (گاز) تجزیه می شود.
قرار گرفتن در معرض کلرات سدیم برای مدت طولانی ممکن است اثرات مضری بر بدن انسان داشته باشد. می تواند باعث قرمزی چشم و پوست، گلودرد و درد شکم شود. همچنین می تواند باعث کبودی لب ها یا پوست و شرایط پزشکی مانند اسهال، تهوع، استفراغ، تنگی نفس و بیهوشی شود.

خواص فیزیکی کلرات سدیم
یک ترکیب بی بو است.
رنگ آن از زرد روشن تا جامد کریستالی سفید متفاوت است.
بسیار محلول در آب و سنگین تر از آب است. از این رو، می تواند با سرعت زیادی غرق شود و تجزیه شود.
در حالی که به خودی خود یک ماده منفجره نیست، اما در تماس با آب می تواند باعث احتراق قوی شود. باعث واکنش شدید گرمازا می شود. حتی اگر 30 درصد مولکول ها در آب باشند، به دلیل خواص ذاتی خود می توانند یک واکنش اکسید کننده قوی ایجاد کنند.
چگالی آن 2.49 گرم بر سانتی متر است.
نقطه جوش کلرات سدیم 300 درجه سانتیگراد و نقطه ذوب 248 درجه سانتیگراد است.
همچنین در برخی از حلال های آلی مانند گلیسرول و متانول کاملا محلول و مقدار کمی در استون محلول است.
ساختار کریستالی مکعبی دارد.
خواص شیمیایی کلرات سدیم
یک عامل اکسید کننده قوی است. یون هیپوکلریت به اکسید شدن و سفید شدن هر ماده شیمیایی کمک می کند.
ظرفیت حرارتی آن 104.6 Jmol/K است.
واکنش آن با برومید پتاسیم و اسید کلریدریک محصولاتی مانند کلرید پتاسیم، کلرید سدیم، برم و آب به دست میدهد.
NaClO3 + 6KBr + 6HCl → 6KCl + NaCl + 3H2O + 3Br2
واکنش شیمیایی آن با یدید پتاسیم و اسید کلریدریک باعث تولید محصولاتی مانند کلرید سدیم، کلرید پتاسیم، ید و آب می شود.
NaClO3 + 6KI + 6HCl → NaCl + 3I2 + 3H2O + 6KCl
می تواند با بسیاری از ترکیبات شیمیایی مختلف مانند سایر برومیدها و اسیدها واکنش نشان دهد. هنگامی که در تماس نزدیک با چوب، یا هر ماده مشابه دیگری مانند اسید سولفوریک، فلزات مختلف و مواد مصنوعی مختلف قرار می گیرد، ممکن است باعث شعله و انفجار شود.
به دلیل خاصیت انفجاری ناشی از ماهیت اکسید کننده بالا، به طور جداگانه نگهداری می شود و در محیط کنترل شده استفاده می شود.

تهیه سدیم کلرات
کلرات سدیم از الکترولیز آب شور ساده (کلرید سدیم و آب) تولید می شود.
NaCl + 3H2O + 6 e-→ NaClO3 + 3H2.
این فرآیند در طبیعت گرمازا است. در چند مرحله رخ می دهد. همچنین، تغییرات pH و دما در تولید آن موثر است.
تهیه کلرات سدیم بسیار ساده است، گاز کلر (Cl2) در آند و گاز هیدروژن (H2) در کاتد ذخیره می شود. سپس کلر در سلول به یک گروه آنیون هیپوکلریت هیدرولیز می شود که در آن نقطه کلرات سدیم تولید می کند.
ذرات کلرات سدیم به شکل کریستال تشکیل می شوند. محلول به دست آمده پس از هیدرولیز اغلب مایع سلولی نامیده می شود. سپس محلول از دستگاه خارج می شود. کریستال های به دست آمده شسته و خشک می شوند و سپس در یک منطقه خشک نگهداری می شوند. بسته به کاربرد، ممکن است به صورت کریستال یا مایع فروخته شود.
موارد مصرف کلرات سدیم
جهت ساخت علف کش ها، مواد منفجره، رنگ ها، کبریت ها، جوهرها، زیباکننده ها، داروها، برگ زدایی ها، کاغذ و پوست گوساله استفاده می شود.
به عنوان پوره در صنعت ساخت کاغذ استفاده می شود.
در فرآیند Solvay استفاده می شود
به عنوان یک اکسید کننده در فرآیندهای رنگ سازی در مقیاس بزرگ و سفید کننده استفاده می شود.
در زمینه پزشکی برای تهیه داروهای مختلف استفاده می شود.
در ساخت کودها و مواد منفجره استفاده می شود.
با حرارت دادن، کلرات سدیم به کلرید سدیم (جامد) و اکسیژن (گاز) تجزیه می شود.
قرار گرفتن در معرض کلرات سدیم برای مدت طولانی ممکن است اثرات مضری بر بدن انسان داشته باشد. می تواند باعث قرمزی چشم و پوست، گلودرد و درد شکم شود. همچنین می تواند باعث کبودی لب ها یا پوست و شرایط پزشکی مانند اسهال، تهوع، استفراغ، تنگی نفس و بیهوشی شود.


