با اشتراک در خبرنامه همیشه از آخرین تخفیفات و رویدادهای مهم ما مطلع خواهید شد
مروری بر نیترات پتاسیم از سایت example.com
نیترات پتاسیم که به عنوان شوره نیز شناخته می شود، یک ترکیب شیمیایی با فرمول KNO3 است. این جامد کریستالی خاکستری سفید یک عنصر کلیدی در کاربردهای مختلف است، به ویژه در کودها به عنوان منبع نیتروژن و پتاسیم - دو ماده مغذی حیاتی برای گیاهان محسوب می شود. همچنین از نظر تاریخی در تولید باروت اهمیت دارد. نیترات پتاسیم که به طور طبیعی در ذخایر معدنی یافت می شود، محلول در آب است و دارای خواصی است که آن را در نگهداری مواد غذایی و حتی در آتش بازی ها ارزشمند می کند، جایی که به عنوان یک اکسید کننده برای تولید رنگ های درخشان عمل می کند
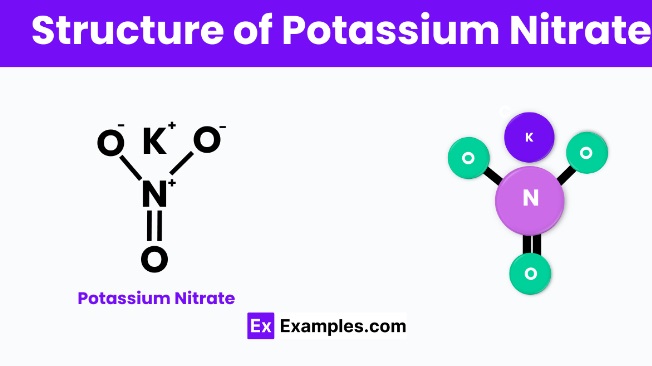
ساختار نیترات پتاسیم
نیترات تاسیم یک ترکیب شیمیایی است که از اتم های پتاسیم (K)، نیتروژن (N) و اکسیژن (O) تشکیل شده است. این نشان می دهد که هر مولکول از یک اتم پتاسیم، یک اتم نیتروژن و سه اتم اکسیژن تشکیل شده است. از نظر ساختاری، یون پتاسیم (K+) و یون نیترات (NO3-) از طریق پیوندهای یونی به یکدیگر متصل می شوند. این بدان معناست که اتم پتاسیم برای رسیدن به آرایش الکترونیکی پایدار یک الکترون را رها می کند و این الکترون توسط گروه نیترات به دست می آید و یک ساختار یونی پایدار ایجاد می کند. در حالت جامد، نیترات پتاسیم معمولاً ساختار بلوری را تشکیل میدهد که در آن هر یون پتاسیم توسط یونهای نیترات متعدد احاطه شده است و بالعکس، در یک الگوی تکراری برای تشکیل شبکه کریستالی جامد قرار میگیرد. این ساختار برای کاربردهای مختلف آن، از کود گرفته تا باروت، حیاتی است، زیرا تضمین میکند که ترکیب در شرایط مناسب پایدار و در عین حال واکنشپذیر است.
تهیه نیترات پتاسیم
نیترات پتاسیم را می توان از طریق یک واکنش شیمیایی ساده که شامل ترکیب کلرید پتاسیم (KCl) با نیترات آمونیوم (NH4NO3) است، تهیه کرد. این فرآیند معمولاً به عنوان روش تجزیه دوگانه شناخته می شود. هنگامی که این دو ترکیب در آب حل می شوند، با یکدیگر تعامل می کنند و یون ها را مبادله می کنند و نیترات پتاسیم و کلرید آمونیوم (NH4Cl) را تشکیل می دهند. واکنش را می توان با معادله شیمیایی نشان داد:
KCl + NH4NO3 → KNO3 + NH4Cl
نیترات پتاسیم تولید شده به این روش، به دلیل کیفیت بالا و خاصیت واکنش پذیری، اغلب در مصارف مختلفی از جمله در کودها و مواد آتش نشانی استفاده می شود.

خواص شیمیایی نیترات پتاسیم
عامل اکسید کننده
نیترات پتاسیم به عنوان یک عامل اکسید کننده قوی عمل می کند. این بدان معنی است که می تواند اکسیژن را برای پشتیبانی از احتراق مواد دیگر فراهم کند. این ویژگی در استفاده از آن در آتش بازی و باروت بسیار مهم است. به عنوان مثال، هنگامی که نیترات پتاسیم در باروت گرم می شود، تجزیه می شود و اکسیژن تولید می کند، که در نتیجه سوزاندن زغال سنگ و گوگرد موجود در مخلوط را تامین می کند.
2KNO3 → 2KNO2 + O2
واکنش با اسید سولفوریک
هنگامی که نیترات پتاسیم با اسید سولفوریک غلیظ (H2SO4) مخلوط می شود، اسید نیتریک (HNO3) و بی سولفات پتاسیم (KHSO4) را تولید می کند. این روشی برای تولید اسید نیتریک در آزمایشگاه است.
KNO3 + H2SO4 → HNO3 + KHSO4
تجزیه حرارتی
با گرم شدن، نیترات پتاسیم تجزیه حرارتی می شود. این فرآیند برای تولید اکسیدهای نیتروژن که از مواد شیمیایی صنعتی مهم هستند استفاده می شود.
2KNO3 → 2KNO2 + O2
موارد استفاده از نیترات پتاسیم
کود
نیترات پتاسیم به طور گسترده ای به عنوان کود در کشاورزی استفاده می شود. پتاسیم و نیتروژن را برای گیاهان فراهم می کند، دو ماده مغذی ضروری که از رشد گیاه پشتیبانی کرده و کیفیت میوه را بهبود می بخشد.
مواد منفجره و آتش بازی
نیترات پتاسیم به دلیل خاصیت اکسید کنندگی یک جزء کلیدی در باروت و آتش بازی است. هنگامی که گرم می شود، اکسیژن آزاد می کند که به سوختن سایر مواد در مخلوط کمک می کند و واکنش های انفجاری مورد نیاز برای آتش بازی و مهمات را ایجاد می کند.
نگهداری مواد غذایی
نیترات پتاسیم در طول تاریخ در پخت گوشت استفاده می شده است. این به حفظ گوشت کمک می کند، از رشد باکتری ها جلوگیری می کند و رنگ صورتی را در محصولات پخته شده مانند سالامی و ژامبون حفظ می کند.
مواد تشکیل دهنده خمیر دندان
در مراقبت از دندان، نیترات پتاسیم به عنوان یک عامل حساسیت زدا در خمیر دندان استفاده می شود. با آرام کردن اعصاب دندان به کاهش حساسیت دندان به محرک های گرم، سرد، اسیدی یا شیرین کمک می کند.
تولید شیشه
در تولید شیشه از نیترات پتاسیم به عنوان شار استفاده می شود که به کاهش دمای ذوب مخلوط شیشه کمک می کند و خواص نوری شیشه را بهبود می بخشد.
نمک های عملیات حرارتی
نیترات پتاسیم در نمک های عملیات حرارتی استفاده می شود که در آن با نیتریت سدیم مخلوط می شود تا یک حمام مذاب برای سخت شدن سطح فولاد ایجاد شود. این فرآیند باعث افزایش چقرمگی و مقاومت در برابر سایش قطعات فولادی می شود.
پیروتکنیک
فراتر از آتش بازی، نیترات پتاسیم در سایر کاربردهای پیروتکنیک مانند بمب های دودزا و شراره ها استفاده می شود، جایی که به عنوان یک اکسید کننده برای تولید دود متراکم و رنگ های زنده عمل می کند.
سرامیک
نیترات پتاسیم در لعاب استفاده می شود. این ماده به عنوان یک عامل اکسید کننده عمل می کند و به بهبود سطح و رنگ بندی محصولات سرامیکی کمک می کند.
نیترات پتاسیم: اثرات بر بدن انسان
تحریک: نیترات پتاسیم می تواند پوست، چشم ها و ریه های شما را تحریک کند. تماس ممکن است باعث قرمزی و احساس سوزش شود.
سمیت: خوردن زیاد نیترات پتاسیم مضر است. علائم شامل درد معده، حالت تهوع، استفراغ و اسهال است. همچنین می تواند به کلیه های شما آسیب برساند یا بر ضربان قلب شما تأثیر بگذارد.
کاهش انتقال اکسیژن: این ماده شیمیایی می تواند خون شما را برای حمل اکسیژن سخت کند و باعث تنگی نفس، رنگ آبی پوست و سرگیجه شود.
واکنش های آلرژیک: برخی از افراد ممکن است به نیترات پتاسیم آلرژی داشته باشند که به صورت بثورات پوستی، خارش یا مشکلات تنفسی مانند خس خس سینه ظاهر می شود.
کاهش حساسیت دندان: نیترات پتاسیم در خمیر دندان برای دندان های حساس مفید است زیرا به کاهش درد دندان کمک می کند.
عوارض جانبی نیترات پتاسیم
تحریک پوست و چشم: لمس نیترات پتاسیم می تواند پوست و چشم های شما را قرمز و خارش کند. برای جلوگیری از این امر از وسایل ایمنی استفاده کنید.
مشکلات تنفسی: تنفس گرد و غبار نیترات پتاسیم می تواند باعث سرفه و گلودرد شود. همچنین می تواند تنفس را سخت کند.
ناراحتی های گوارشی: خوردن نیترات پتاسیم می تواند باعث ناراحتی معده از جمله تهوع، استفراغ و اسهال شود.
متهموگلوبینمی: این ماده شیمیایی می تواند خون شما را به نوعی تبدیل کند که اکسیژن را به خوبی حمل نمی کند و باعث علائمی مانند خاکستری آبی، تنگی نفس، خستگی و گیجی شود.
واکنش های آلرژیک: برخی از افراد ممکن است واکنش های آلرژیک مانند کهیر، خارش و تورم ناشی از نیترات پتاسیم داشته باشند. در موارد شدید، می تواند تهدید کننده زندگی باشد.
افزایش ضربان قلب: مقادیر زیاد نیترات پتاسیم می تواند ضربان قلب شما را افزایش داده و بر سلامت قلب شما تأثیر بگذارد.


